جائزة نوبل في الكيمياء 2024: الاكتشافات في عالم البروتينات

تسلط هذه الجائزة الضوء على أهمية سبر أغوار عالم البروتينات من خلال استخدام الذكاء الاصطناعي، سواء في توقع بنى البروتينات المعروفة تقريبًا أو دراسة اللبنات الأساسية للحياة. كما يتمكن العلماء من استغلال هذه المعرفة لتطوير بروتينات جديدة كليًا.
كيف يعمل البروتين؟
لفهم أهم ما تحمله جائزة نوبل لهذا العام، نجد أنه ينبغي أن نبدأ بفهم طبيعة الجينات، التي تعمل كشفرات وراثية تُورث من الأبناء إلى الآباء. يمكن تصوير الجسم كفيلم يتكون من مشاهد تتفاعل مع بعضها، حيث يتجلى كل جين في شكل وحدة كيميائية موجودة في الحمض النووي داخل خلايا الجسم.
تتألف خلايانا البشرية من تسلسل طويل من تلك الوحدات الكيميائية، حيث تمثل كل وحدة جينًا معينًا، يحدد خصائص مثل لون الشعر والعينين وطول القامة. يقوم الجسم في نهاية المطاف بتحويل تلك الشفرات الجينية إلى بروتينات.
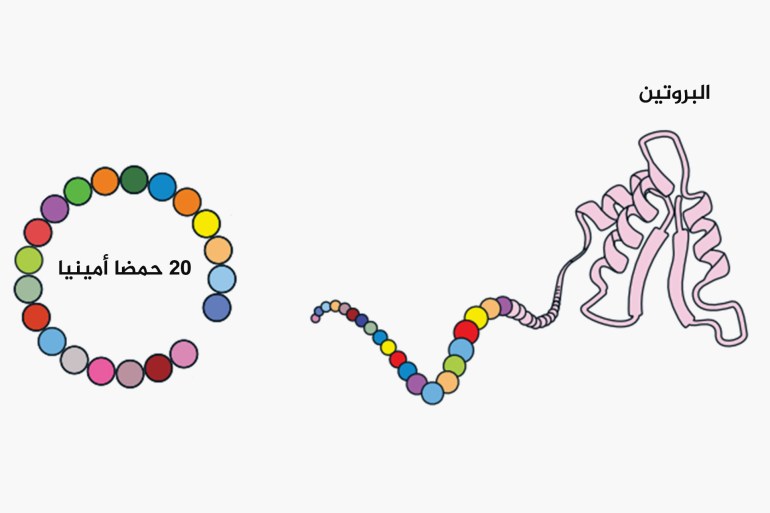
البروتينات تشكل أساس كل ما لدينا في الجسم، بداية من عضلاتنا وصولًا إلى أدق الأجزاء في خلايا الجسم. تلعب دورًا رئيسيًا في إصلاح الأنسجة وبناءها والتحكم في تفاعلات كيميائية مهمة مثل الهضم، بالإضافة إلى نقل العناصر الحياتية مثل الأكسجين.
تتكون البروتينات من وحدات أصغر تعرف بالأحماض الأمينية، حيث لدينا فقط 20 نوعًا منها. هذه الأحماض الأمينية تتصل ببعضها البعض في ترتيبات متنوعة، مشابهة إلى تجميع قطع ليغو، مما يتيح تنوعًا غير محدود في شكل البروتينات ووظائفها. إن كيفية ترتيب تلك الأحماض هو ما يحدد شكل البروتينات وفائدتها بالنسبة لك.
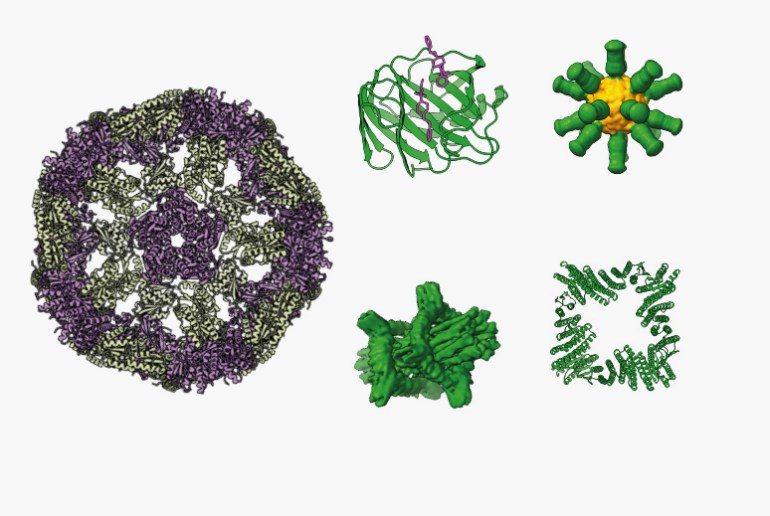
تطوي البروتين العجيب
لطالما حاول العلماء فهم كيفية ترتيب الأحماض الأمينية وتشكيلها، مما يؤدي إلى تشكيل البروتينات، وهذه العملية تُعرف باسم “تطوي البروتين”. الأحماض الأمينية تتشابك وتلتف لتكون بنية ثلاثية الأبعاد مميزة تعطي البروتينات وظائفها الأساسية.
منذ القرن التاسع عشر، أدرك الكيميائيون أهمية البروتينات في جميع عمليات الحياة. ومع ذلك، لم تبدأ أدوات البحث العلمي في التقدم بشكل ملحوظ حتى الخمسينيات من القرن العشرين. كان هناك اكتشاف رائد من قبل الباحثين في جامعة كامبريدج، جون كيندرو وماكس بيروتز، عندما استخدما تقنية “علم استكشاف البلورات بالأشعة السينية” ليقدما أول نماذج ثلاثية الأبعاد للبروتينات، مما أكسبهما جائزة نوبل في الكيمياء عام 1962.
أعقد مما نظن
على الرغم من الاستفادة من تقنيات البلورات بالأشعة السينية لإنتاج صور لنحو 200 ألف بروتين مختلف، كانت هذه الأساليب تتطلب جهدًا كبيرًا وبطيئة للغاية. وفي الوقت نفسه، قام كريستيان أنفينسن، وهو عالم أمريكي، بإجراء أبحاث حول كيفية فتح البروتينات وإعادة تشكيلها بطرق مبتكرة. وجدت أبحاثه أنه بغض النظر عن كيفية تغيير البروتين، فهو يعود دائمًا إلى الشكل نفسه، مما يعني وجود طرق محددة للتطوي.
هذه الاكتشافات قادت أنفينسن إلى الفوز بجائزة نوبل في الكيمياء عام 1972، توضح أن لدينا معلومات قيمة حول بناء أجسامنا وأيضًا الكائنات الحية الأخرى.
لاعب الشطرنج وصديقه
في عام 1994، بدأ الباحثون مشروع “التقدير التنبؤي لبنية البروتين” الذي تحول إلى مسابقة علمية حيث يتنبأ المشاركون بهياكل البروتين بناءً على تسلسلات الأحماض الأمينية. رغم اجتذاب هذا التحدي العديد من الباحثين، تبين أن المشكلة كانت أكثر تعقيدًا مما تصور الكثيرون.
تقنيات الذكاء الاصطناعي أحدثت تحولًا جذريًا في هذا المجال. في عام 2018، تميز الدكتور ديميس هاسابيس، المؤسس المشارك لشركة “ديب مايند”، بإدخال نموذج ذكاء اصطناعي يُدعى “ألفا فولد” في المسابقة. هذا النموذج استطاع الوصول إلى دقة تقدر بـ60% في توقع الهياكل البروتينية، مما يمثل تقدمًا كبيرًا مقارنةً بالدقة البالغة 40% التي حققها الباحثون قبل ذلك.
هذا التقدم من شأنه أن يكشف المزيد من الأنماط المعقدة في تركيب البروتينات، مما قد يساهم في توسيع آفاق المعرفة العلمية حول الحياة والمكونات الحيوية.### تطور التنبؤ ببنية البروتين: رحلة من التحدي إلى الإنجاز
تجاوزت دقة تنبؤات الهيكل البروتيني 90%، مما أحدث ثورة في مجال الأبحاث البيولوجية. على الرغم من الجهود التي بذلها فريق الباحثين في تطوير خوارزميات متعددة، إلا أنهم أدركوا الحاجة إلى خبرات جديدة لتحقيق نتائج أفضل. وهنا جاء دور جون جامبر، الذي بدأ في عام 2011 بتطوير أساليب أبسط وأكثر ابتكارًا لمحاكاة ديناميكيات البروتين.
دخول “ألفا فولد 2” في حلبة المنافسة
جذب اهتمام جامبر مسابقة “التقدير التنبؤي لبنية البروتين”، وفي عام 2017 انضم إلى فريق هاسابيس في ديب مايند، حيث ساعد في إطلاق النسخة الجديدة “ألفا فولد 2”. تم تزويد هذه النسخة بشبكات عصبية اصطناعية قادرة على تحديد الأنماط في كميات ضخمة من البيانات بفعالية، مما ساعد على تحقيق أهداف محددة بكفاءة أكبر.
نهاية تحدي كيمياء البروتين
بحلول عام 2020، أدرك منظمو المسابقة أن تحدي الكيمياء الحيوية، الذي استمر لمدة خمسين عامًا، قد حُسم بشكل نهائي. فقد تمكن “ألفا فولد 2” من تحقيق نتائج تتجاوز 90% في دقة التنبؤ ببنية البروتين. كذلك، تمكن الباحثون من توقع بنية جميع البروتينات البشرية، بما بلغ عدده 200 مليون بروتين تم التعرف عليهم حتى الآن.
ديفيد بيكر ورؤية جديدة في تصميم البروتينات
في عام 1998، انضم ديفيد بيكر إلى المسابقة الكبرى مع خوارزمية تُعرف باسم “روزيتا فولد”. ثم جاءته فكرة مبتكرة حول استخدام هذه البرامج لتوقع تركيب البروتين بشكل عكسي. بدلاً من إدخال تسلسلات الأحماض الأمينية لاستخراج هياكل البروتين، بدأ بإدخال بنية البروتين المرغوبة للحصول على اقتراحات تسلسل الأحماض الأمينية اللازمة.
بناء بروتينات جديدة
يركز مجال تصميم البروتينات على قدرة الباحثين على إنشاء بروتينات جديدة بتصميمات ووظائف مبتكرة. كما طرح بيكر فكرة بسيطة: إذا كنت ترغب في بناء طائرة، عليك أن تفهم أولويات الديناميكا الهوائية. بناءً على معرفته الحالية، عمل فريقه على خلق بروتينات جديدة، حيث استخدمت “روزيتا فولد” قاعدة بيانات تحتوي على هياكل البروتين المعروفة لتحديد القطع القصيرة المشابهة للهيكل المطلوب. وبفضل تلك التحسينات، تمكّنوا من بناء بروتين جديد سُمي “توب 7″، الذي احتوى على 93 حمضًا أمينيًا وغير موجود في الطبيعة.
النجاح وأثره على الأبحاث العلمية
أعلن بيكر عن اكتشاف “توب 7” عام 2003، كخطوة أولى في مسار تطوري استثنائي. تُعتبر البروتينات مكونات أساسية لأجسادنا، وفهم كيفية عملها يساهم في تعزيز الوعي بمعالجة الأمراض وتحسين الأنظمة العلاجية. لقد ساهمت إنجازات هذا الفريق بشكل كبير في تعزيز الأبحاث في مجالات الطب الدقيق والاضطرابات الوراثية وبناء لقاحات جديدة، مما يُسرع من اكتشاف الأدوية وتطويرها.
المصدر: الجزيرة ومواقع إلكترونية.